PSA-d täiendavad uued biomarkerid tõhustavad eesnäärmevähi avastamist ja ravi
Uued biomarkerid eesnäärme- ehk prostataspetsiifilise antigeeni (PSA) testimisel annavad võimaluse määrata parima võimaliku diagnostika ja ravi, mis on eriti oluline madala riskiga haiguse aktiivse jälgimise protsessis.
Prostataspetsiifilise antigeeni kasutuselevõtmine on aidanud vähendada eesnäärmevähi suremust, ent toonud endaga kaasa ka haiguse ülediagnoosimise, liigse ravimise ja olulise hulga ebavajalikke eesnäärme biopsiaid. Nüüdseks on tuvastatud uusi biomarkereid, mis annavad PSA testile vajalikku lisainfot, aidates parandada diagnostika spetsiifilisust, hinnata haiguse agressiivsust ja ennustada kliinilist tulemit.
PSA test ei sobi rahvastikupõhiseks sõeluuringuks
PSA testimise eesmärk on tuvastada eesnäärmevähk (ENV) võimalikult vara. Seda kasutatakse ka haiguse jälgimiseks meestel, kellel on diagnoositud madala riskiga ENV ja kes on suunatud aktiivsele jälgimisele. PSA test on madala spetsiifilisusega, mistõttu on tulemuseks palju negatiivseid biopsiaid ja kliiniliselt ebaoluliste kasvajate tuvastamist. Seetõttu ei soovita näiteks Põhjamaade ravijuhised kasutada PSA testi rahvastikupõhiseks organiseeritud sõeluuringuks. Sellest hoolimata on oportunistliku ehk omaalgatusliku testimise tase kõrge.
Testimise eesmärk on tuvastada kliiniliselt olulised eesnäärmekasvajad, ent PSA kasutamisel diagnostikameetodina on mitmesuguseid puudusi. Eelkõige põhjustab see ENV ülediagnoosimist, aga ka ebavajalikku ravi, sest umbes kahel kolmandikul patsientidest on tegu kliiniliselt mitteolulise haigusega (Gleasoni skoor < 6). ENV diagnoosi kinnitamiseks või välistamiseks suunatakse kõrgenenud PSA tasemega mehed nõelbiopsiale, mis on omakorda seotud võimalike komplikatsioonidega (sepsis) ja sellest põhjustatud hospitaliseerimistega. Ka aktiivse jälgimise käigus tehakse meestele biopsiaid süstemaatiliselt. Ebavajalikud protseduurid ja nendest tulenevad kõrvaltoimed põhjustavad tervishoiusüsteemile olulist ja tegelikkuses välditavat lisakulu, seda eriti madala riskiga haiguse puhul, mis sageli ei muutugi kliiniliselt oluliseks. Probleemiks on ka need kasvajajuhud, kus PSA tõusu ei esine, ent esinev haigus on siiski kliiniliselt oluline.
PSA analüüsi vähene spetsiifilisus põhjustab seega vähileiuta biopsiate tegemist ja kliiniliselt ebaoluliste kasvajate tuvastamist. Seetõttu on hakatud kasutusele võtma eesnäärmevähi riskikalkulaatoreid, mis ühendavad endas PSA taseme koos teiste kliiniliste parameetritega. Riskikalkulaatorite puuduseks on aga nende erinev ennustusvõime eri rahvastikes, mistõttu on riski hindamisele lisaks võetud kasutusele magnetresonantstomograafia (MRI). MRI tundlikkus ja spetsiifilisus aitavad vähendada ebavajalike biopsiate arvu kuni 50% ja MRI juhitud biopsiad võimaldavad leida kliiniliselt olulisi kasvajaid veelgi enam.
Stockholm3 test aitab tuvastada kliiniliselt olulisi kasvajaid
Kahjude vähendamiseks, mida põhjustab biopsiale suunamine pelgalt PSA taseme tõttu, on ENV riski hindamiseks töötatud välja vereproovil põhinevad testid. Nende seas ka Stockholm3 test.
Stockholm3 on vereproovil põhinev test, mis kasutab kliinilisi tunnuseid (vanus, eelmise biopsia tulemus, perekondlik ajalugu, 5-alfa-reduktaasi inhibiitorite kasutamine), vereseerumi valgutaset (PSA, vaba PSA, inimese kallikreiin 2, beeta mikrisemino valk, kasvu diferentseerumise faktor 15) ja polügeenset riskiskoori (saadud ühenukleotiidiliste polümorfismide põhjal) selleks, et hinnata kliiniliselt olulise (Gleasoni skoor 3+3 või kõrgem) eesnäärmevähi tekkeriski.
Mitmed uuringud on näidanud magnetresonantstomograafia (MRI) üha enam esilekerkivat rolli ENV sõeluuringus. MRI-d saab kasutada enne esimese biopsia tegemist, et ennustada selle vajalikkust (ebaselgete lesioonide esinemine), ja seejärel saab võtta biopsia kahtlusalustest piirkondadest. Seega on täpsematel riskihindamise metoodikatel (nagu näiteks Stockholm3) koos MRI juhitud biopsia võtmisega suur potentsiaal panna alus uuele ENV sõeluuringu ajajärgule.
Nordström ja kolleegid tegid 2020. aastal uuringu, mille eesmärk oli hinnata, kas Stockholm3 testi abil on võimalik paremini tuvastada neid mehi, kes vajaksid suunamist MRI juhitud biopsiale, ja hinnata selle meetodi sobivust rahvastikupõhise sõeluuringu strateegiana. Uuringus osalesid 50–74-aastased Stockholmi mehed, kellel määrati kõigepealt PSA tase. Mehed, kelle PSA tase jäi alla 1,5ng/ml, paluti kordusuuringule tulla kuue aasta pärast. Kõrgema PSA tasemega mehed suunati Stockholm3 testile. Mehed, kelle PSA tulemus jäi vahemikku 1,5–3 ng/ml või Stockholmi testi tulemus alla 11%, suunati kordusuuringule kahe aasta pärast. PSA tasemega 3 ng/ml või kõrgem või Stockholm3 tulemus 11% või kõrgem, klassifitseeriti kui kõrgenenud riskitasemega patsiendid ja randomiseeriti kahte gruppi – võrdlusgrupp (tehti PSA test + tavapärane biopsia, 921 meest) ja eksperimentaalgrupp (tehti MRI + MRI juhitud biopsia, 1372 meest). Grupisisesel võrdlusel eksperimentaalgrupis võrreldi samadel meestel Stockholm3 testi tulemusi (piirväärtusega 0,11 ja 0,15) PSA tasemega, gruppide vahelises võrdluses PSA ja tavapärast biopsiat Stockholm3 ja MRI juhitud biopsiaga. Uuringu peamise tulemusena hinnati kliiniliselt olulise ENV esinemist biopsial (Gleasoni skoor 3+4 või kõrgem).
Grupisisene võrdlus eksperimentaalgrupis näitas, et Stockholm3 0,11 või kõrgem tuvastas kliiniliselt olulisi kasvajaid võrdsel määral PSA tasemega 3ng/ml või kõrgem. Ka kliiniliselt ebaolulisi kasvajaid tuvastasid mõlemad meetodid võrdselt, ent Stockholm3 ≥ 0,11 oli seotud rohkemate MRI-de ja biopsiatega. Stockholm 0,15 või kõrgem tuvastas PSA tasemega ≥ 3ng/ml sama palju kliiniliselt olulisi kasvajaid, ent oli seotud vähemate MRI-dega. Kliiniliselt ebaoluliste kasvajate ja biopsiate arv ei erinenud.
Eksperimentaalgruppi ja võrdlusgruppi võrreldes tuvastas nii Stockholm3 ≥ 0,11 + MRI kui ka Stockholm3 ≥ 0,15 + MRI, võrreldes PSA ja tavapärase biopsiaga, rohkem kliiniliselt olulisi kasvajaid ja vähem kliiniliselt mitteolulisi kasvajaid ning põhjustas vähem biopsiaid. Eksperimentaalgrupi meestel esines ka vähem põletikke (biopsia kõrvaltoime) ja sellest põhjustatud hospitaliseerimisi.
Võrreldes sõeluuringutega, mis kasutavad PSA-d koos rektaalse ultraheli abil juhitud biopsiaga, parandas Stockholm3 koos MRI juhitud biopsiaga kliiniliselt oluliste kasvajate tuvastamise määra ja vähendas kliiniliselt ebaoluliste kasvajate tuvastamist. Kuigi viimasel ajal on kasutusse tulnud ka mitmed uued biomarkerid, on neid testitud veel liiga vähe selleks, et kasutada neid rahvastikupõhises sõeluuringus. Diagnostikameetodid, mis hõlmavad nii mitmetegurilist riskihindamist kui ka MRI juhitud biopsiat, vähendavad oluliselt ülediagnoosimist, võrreldes seni kasutusel olnud tavapäraste sõeluuringumeetoditega, mis põhinevad PSA tasemel ja biopsial.
Stockholm3 testi kasutamine Norras vähendas biopsiale saadetud patsientide hulka
Kuigi Norras on kliiniliste ravijuhendite järgi PSA testimine soovitatud vaid geneetilise eelsoodumusega patsientidel, tehakse PSA testimist laialdaselt, ja seda eriti tervishoiu esmatasandil. 2017. aastal tehti uuring, kus Norra Stavangeri piirkonna kõigil perearstidel paluti PSA testimise asemel kasutada Stockholm3 testi. Kõik patsiendid, kelle Stockholm3 riskiskoor oli suurem kui 11%, suunati edasi uroloogi vastuvõtule kui kliiniliselt olulise eesnäärmevähi tekkeks kõrgenenud riskiga patsiendid. Uuringusse kaasatud 4784 mehest oli Stockholm3 test positiivne 995 mehel (21%), samal ajal oli PSA test positiivne (PSA≥3.0 ng/ml) 1387 mehel (29%). Seega said esimese positiivse vastuse Stockholm3 testi kasutades 8% vähem uuringul käinud meestest võrreldes sellega, kui neil oleks diagnoosimiseks kasutatud PSA testi. Lisaks oli 520 mehel (11%) positiivne PSA, aga mitte Stockholm3 test ja 128 mehel (3%) positiivne Stockholm3, aga negatiivne PSA test. 995 meest suunati nõelbiopsiale – seda on 28% vähem, kui see otsus oleks tehtud ainult positiivse PSA leiu põhjal. Kui võrreldi biopsiale saadetud patsientide tulemusi uuringule eelneva perioodiga, leiti et Stockholm3 testi põhjal suunatutest esines kliiniliselt olulisi eesnäärmekasvajaid 64,9% juhtudest, võrreldes varasema 42,1%-ga, mis viitab, et Stockholm3 on tundlikum test ja aitab vähendada ülediagnoosimist. Et vältida ebavajalikku testimist veelgi, anti uuringus osalenud meestele, kelle Stockholm3 risk oli ≤3%, soovitus pikendada perioodi kontrolluuringute vahel.
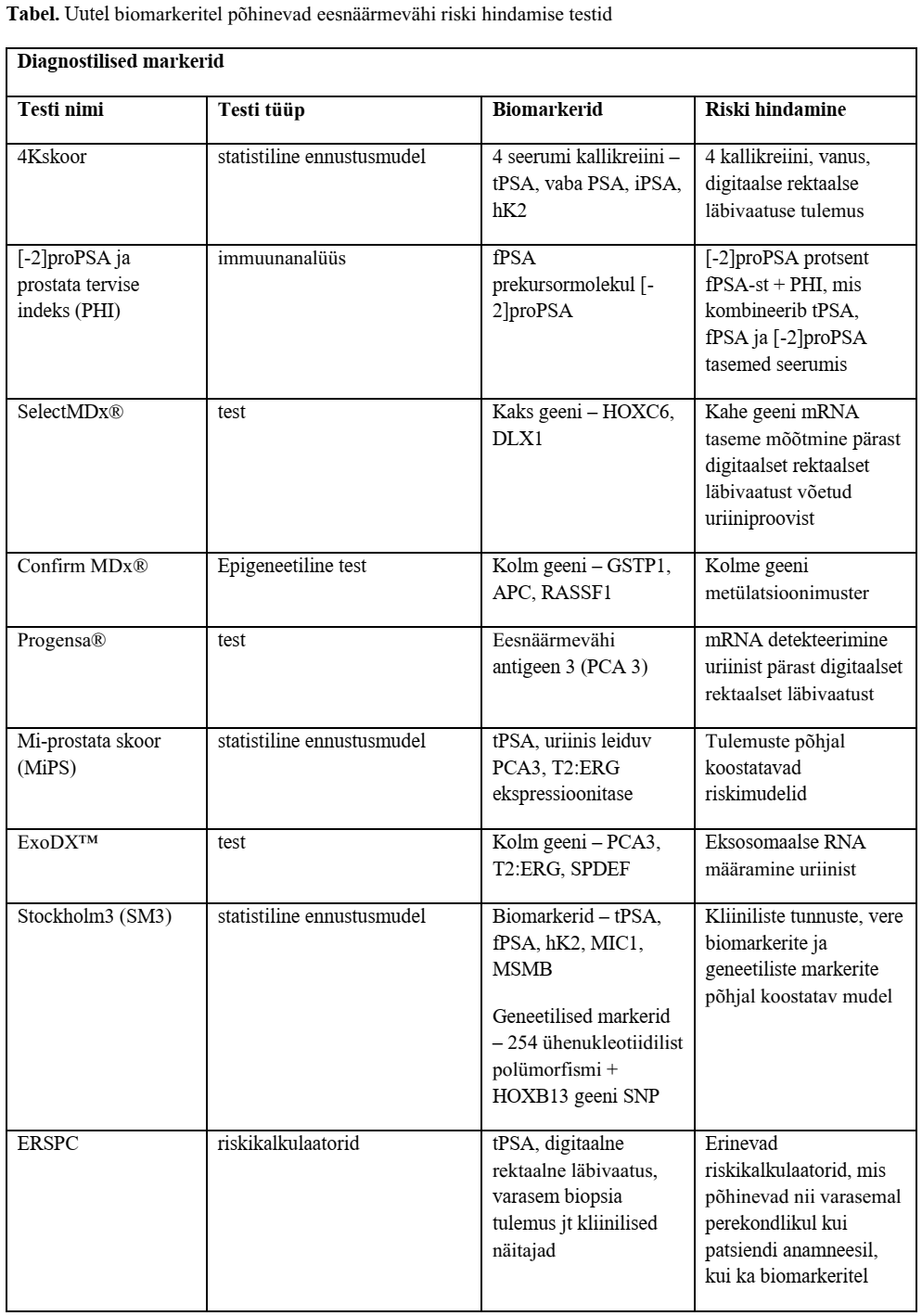
Uued diagnostilised biomarkerid
Kuigi PSA on oluline biomarker eesnäärmevähi diagnoosimises ja ravis, on 60–80% ainult PSA näidustatud biopsiatest vähileiuta ehk ebavajalikud. PSA analüüsi vähene spetsiifilisus on probleemiks ka seetõttu, et PSA taseme tõusu põhjustavad mitmesugused healoomulised haigused (põletik, trauma, healoomuline eesnäärme hüperplaasia). Seega on alates 1990. aastast püütud arendada uusi strateegiaid spetsiifilisuse parandamiseks (vt tabelit). PSA on endiselt enim kasutatud biomarker, ent viimastel aastatel on arendatud mitmesuguseid uusi diagnostikameetodeid, mis post-PSA ajastul aitavad arstidel otsustada biopsia tegemise vajaduse üle ja määrata parima võimaliku ravi.
Refereeringu koostas TAI teadur Keiu Paapsi
Allikad:
Viste E, Vinje CA, Lid TG, Skeie S, Evjen-Olsen Ø, Nordström T, Thorsen O, Gilje B, Janssen EAM, Kjosavik SR. Effects of replacing PSA with Stockholm3 for diagnosis of clinically significant prostate cancer in a healthcare system - the Stavanger experience. Scand J Prim Health Care. 2020 Sep;38(3):315–322. doi: 10.1080/02813432.2020.1802139. Epub 2020 Aug 8. PMID: 32772613; PMCID: PMC7470071.
Garrido MM, Bernardino RM, Marta JC, Holdenrieder S, Guimarães JT. Tumour markers in prostate cancer: The post-prostate-specific antigen era. Ann Clin Biochem. 2022 Jan;59(1):46-58. doi: 10.1177/00045632211041890. Epub 2021 Aug 31. PMID: 34463154.
Nordström T, Discacciati A, Bergman M, Clements M, Aly M, Annerstedt M, Glaessgen A, Carlsson S, Jäderling F, Eklund M, Grönberg H; STHLM3 study group. Prostate cancer screening using a combination of risk-prediction, MRI, and targeted prostate biopsies (STHLM3-MRI): a prospective, population-based, randomised, open-label, non-inferiority trial. Lancet Oncol. 2021 Sep;22(9):1240–1249. doi: 10.1016/S1470-2045(21)00348-X. Epub 2021 Aug 13. PMID: 34391509.